LA MUERTE CELULAR PROGRAMADA.
Las células proliferativas, quiescentes y
fijas-postmitóticas pueden ser eliminadas en cualquier momento de su ciclo
celular.
Esta eliminación
puede estar mediada por mecanismos internos celulares o por la acción de
agentes externos. La apoptosis es el proceso por el cual una célula entra en
degeneración y termina con su eliminación al activarse un mecanismo
intracelular (un proceso interno). Por las peculiaridades que presenta, también
es conocida como “suicidio celular” o “muerte celular programada” (MCP). La
necrosis es el resultado de la muerte y eliminación de la célula, pero en este
caso se produce como consecuencia de la acción de un agente externo
(traumatismo, etc.).
Aunque la apoptosis y la necrosis tienen un final común,
cual es la eliminación de la célula afectada, ambos procesos como ya hemos
comentado, tienen un inicio o desencadenante diferente. Pero lo más
característico de ambos es que los sistemas que empleará la célula para
conducir a su muerte son diferentes y, su conocimiento ha producido un
importante avance en el campo de la investigación de la longevidad celular.
La necrosis de una célula sucede cuando algún agente externo
(traumatismo, tóxico, agentes infecciosos, etc.) actúa sobre ella induciendo su
muerte. Las células que degeneran ocasionan una serie de reacciones locales que
conducen a respuestas de tipo inflamatorio que son probablemente la
manifestación más importante de este proceso.
La acción del agente inductor de la necrosis produce una alteración
en las membranas plasmática y mitocondrial, donde se alojan las bombas iónicas
(fundamentalmente de Na+, K+ y Ca++) que se encargan de mantener el adecuado
equilibrio iónico intra-extracelular. Esta alteración en los sistemas
homeostáticos dispara un mecanismo de defensa frente a la alteración de la
homeostasis. Así, el núcleo de la célula comienza a transcribir ADN con
información para la síntesis de proteínas protectoras de la célula (hsp –
heat-shock proteins-, chaperonas). En ocasiones estas proteínas son capaces de
restaurar las funciones celulares, pero en otras no y es entonces cuando la
célula continuará de manera inevitable hacia su destrucción.
Los iones Na+ y Ca++ comienzan a entrar en la célula y son
acompañados de agua, para mantener el equilibrio osmótico, lo que determina que
los diversos organoides celulares (mitocondrias, retículo, etc.) sufran un
proceso de hinchazón y fragmentación intracelular (Figura 5). Asimismo el
citosol se llena de agua y electrolitos y, la célula en su conjunto sufre un
proceso de turgencia general que conduce a una vacuolización, ruptura de la
membrana citoplasmática e inicio de una reacción inflamatoria por la liberación
de moléculas proinflamatorias (Edinger y Thompson, 2004).
Los macrófagos locales, células con capacidad fagocítica del
tejido muerto, comienzan un proceso de fagocitosis para eliminar los restos
celulares necróticos. Si la población celular en necrosis es muy elevada, puede
ser necesario el reclutamiento de más células que actúen en el proceso de
limpieza como son los monocitos, que abandonarán el torrente sanguíneo para ingresar
en el tejido lesionado, donde se transforman en macrófagos para incrementar la
fagocitosis. Esto se desarrolla en el contexto de una reacción inflamatoria y
unido a otras manifestaciones producirá las expresiones clínicas (calor, dolor
y rubor) y bioquímicas (liberación de interleucinas, etc.) ya conocidas. La
necrosis tiene una significación funcional menos importante que la apoptosis,
desde el punto de vista del envejecimiento.
5.4.2 La apoptosis
 Desde el punto de vista del envejecimiento, el proceso de
eliminación de células por apoptosis tiene una significación funcional más
importante. Durante el desarrollo embrionario y en las fases posteriores además
de la proliferación celular se produce, de forma fisiológica, un proceso de
remodelación de los órganos de la economía que implica la muerte “programada”
de numerosas células. Sin este proceso de muerte celular programada nuestro
organismo tendría una morfología difícil de reconocer y probablemente muchas de
sus funciones estarían comprometidas. Por medio de
Desde el punto de vista del envejecimiento, el proceso de
eliminación de células por apoptosis tiene una significación funcional más
importante. Durante el desarrollo embrionario y en las fases posteriores además
de la proliferación celular se produce, de forma fisiológica, un proceso de
remodelación de los órganos de la economía que implica la muerte “programada”
de numerosas células. Sin este proceso de muerte celular programada nuestro
organismo tendría una morfología difícil de reconocer y probablemente muchas de
sus funciones estarían comprometidas. Por medio de
Si bien, durante el desarrollo, el proceso de MCP era bien
conocido, fueron los estudios de Kerr et al., 1972, los que mostraron que
representaba la forma “natural” de eliminación de células a lo largo de toda la
vida del organismo, incluido el envejecimiento. Estos autores sugirieron que la MCP que ocurría en el adulto
debía denominarse apoptosis (del griego “caerse”), en semejanza a la caída
otoñal de las hojas de los árboles.
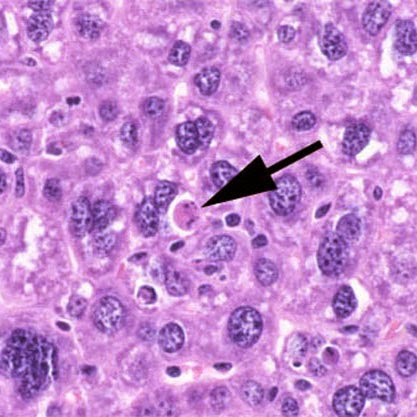
Cuando lo observamos al microscopio el proceso de apoptosis
se caracteriza por el hecho de que la célula adquiere una morfología arrugada a
la cual se asocian cambios específicos en el núcleo y el citoplasma (Figura 5).
El núcleo cambia notablemente de forma y se aprecia como la cromatina, que
normalmente está en forma de eucromatina o cromatina dispersa (indica actividad
transcripcional del ADN), comienza a concentrarse formando cromatina condensada
o heterocromatina (indica que el ADN no está transcribiendo). Finalmente todo
el núcleo se hace muy denso por la condensación total de la cromatina (falta
total de actividad transcripcional del ADN). La consecuencia última de este
proceso es la falta de síntesis de ARN mensajero, ribosómico y de
transferencia, la imposibilidad de la síntesis de proteínas y la consiguiente
muerte y fragmentación de la célula. Este proceso de fragmentación se
manifiesta morfológicamente por la aparición de diferentes vesículas esféricas
(cuerpos apoptóticos), rodeados de membrana celular, que contienen diversos
organoides citoplasmáticos degenerados. Estos cuerpos apoptóticos van siendo
fagocitados por los macrófagos sin ningún tipo de reacción inflamatoria
acompañante. Esta ausencia de reacciones locales del tipo inflamatorio es
fundamental para entender la “limpieza” biológica del proceso de apoptosis en
contraposición al proceso de necrosis.
El mecanismo interno que constituye la muerte celular por
apoptosis se puede desencadenar por estímulos de origen extracelular o
intracelular. El estímulo extracelular más frecuente, durante el desarrollo, es
la falta de factores tróficos encargados de mantener la funcionalidad celular
(v. gr., factor de crecimiento neural –NGF–). Las señales extracelulares en el
adulto, entre las que destacan las moléculas de la familia del factor de
necrosis tumoral, activan la vía extrínseca de la apoptosis por medio de su
unión a receptores específicos de la membrana celular (apoptosis mediada por
receptor). Los estímulos intracelulares más típicos son: la expresión de
mensajes genéticos de suicidio celular, la hipoxia celular o que la célula no
pase los controles –check-points– para entrar en mitosis, como estudiaremos más
adelante (capítulo dedicado a la reparación del ADN).
Sea cual sea el inductor de la apoptosis (extra o
intracelular), la primera reacción por parte de la célula, es la expresión de
genes para la síntesis de un tipo particular de proteínas con alta actividad
enzimática (proteasas). Concretamente las primeras proteasas identificadas que
actúan en la apoptosis son las del tipo ICE, así denominadas por su parecido
estructural con la
Interleukin-1 Converting Enzyme (actualmente se denomina
caspasa 1 y se han identificado más de 11 tipos). Cuando estas proteasas se
activan, actúan sobre otras proteínas celulares o sobre el ADN nuclear
originando su destrucción.
Basándose en sus funciones proapoptóticas, las caspasas se
han dividido en dos grupos: caspasas iniciadoras y caspasas efectoras. Las
iniciadoras actúan sobre las efectoras que son en definitiva las que degradan
múltiples sustratos, incluyendo proteínas estructurales y enzimáticas en el
núcleo y el citoplasma celular. Además las mitocondrias se afectan por el daño
apoptótico y se origina la liberación del citocromo-c y la formación de
apoptosomas (complejos de proteínas conteniendo el citocromo-c). Una vez que se
forma el apoptosoma se le une la caspasa-9, desencadenando una cascada de
reacciones de proteolisis que conducen a la muerte celular.
5.4.3 Inmunosenescencia
El sistema inmune posee dos vías para responder a los
antígenos: la respuesta inmune celular y la humoral. La inmunidad celular
implica a las diferentes familias de linfocitos T, mientras que la respuesta de
inmunidad humoral implica a los linfocitos de tipo B.
Figura 6. Esquema que muestra las vías de activación de
las respuestas de inmunidad celular y humoral. El linfocito T4 (CD4+) se activa
por la célula presentadora de antígenos y libera citoquinas que a su vez
activan a linfocitos B para la formación de anticuerpos. Por otra parte también
la célula CD4+ activa linfocitos citotóxicos (CD8+) que liberan perforina que
agujerea la membrana del agente extraño y produce su destrucción (imagen tomada
de lyC; adaptado de López Moratalla, 1998).
5.4.3.1 Inmunosenescencia celular
El modelo celular más ampliamente utilizado para el estudio
de la apoptosis ha sido el linfocito de origen tímico (célula o linfocito T).
El timo es un órgano linfoide primario que tiene como función fundamental la
formación de linfocitos T. En las primeras etapas del desarrollo uterino
(semanas 7-8), el saco vitelino forma linfocitos inmaduros que, vía el torrente
sanguíneo, llegan a colonizar el timo (timocitos) que en esos momentos se está
formando. La función de los timocitos es proliferar en un ambiente libre de
antígenos y formar de esta manera linfocitos T maduros, reconocibles porque ya
poseen en su superficie receptores específicos de estas células (receptor T).
Las células T maduras abandonan el timo y van colonizando el resto de órganos
linfoides y tejidos conjuntivos, donde ejercen una función de defensa frente a
microorganismos invasores. Además vigilan la composición molecular del
organismo y destruyen aquellas células que expresan mutaciones que pueden
conducir a la formación de neoplasias.
Lo que nos interesa resaltar del timo y de los linfocitos T
son dos peculiaridades. En primer lugar, un aspecto importante referido a la
maduración de los linfocitos T, es que la gran mayoría de ellos (95%) no
cumplen los criterios biológicos de madurez inmunológica y entran en un proceso
de apoptosis. Esto se debe a una selección negativa que impide la maduración de
linfocitos T auto-reactivos. De esta manera se eliminan las células T que
reconocen lo propio como extraño, patología que se encuentra en la base de las
enfermedades autoinmunes. En segundo lugar, el timo es un órgano transitorio,
pues, después de sembrar de linfocitos T nuestro organismo, llegada la pubertad
comienza a degenerar (la llamada involución etaria) y va siendo sustituido por
tejido conjuntivo y material graso de tal manera que en el adulto este órgano
no es ya reconocible (Pantelouris, 1973). Algunos autores han señalado la
desaparición del timo como el principio del envejecimiento.
Las células T también envejecen, en el sentido de que su activación
se vuelve más lenta y menos eficaz y la respuesta proliferativa al estímulo de
la citoquina IL-2 está muy disminuida. Además unen una proteína llamada
FAS-ligando (FAS-L o LFAS) a la proteína FAS de la célula a destruir. FAS es
una proteína transmembrana que sirve, por medio de su dominio externo, para
informar a la célula de las variaciones en el microambiente extracelular. La
activación de FAS induce el inicio de la apoptosis y los linfocitos T liberan
perforinas que crean agujeros en la membrana de la célula a destruir. El
proceso de envejecimiento repercute de forma importante en la calidad y
cantidad de la respuesta inmune.
Para activar la inmunidad celular, el antígeno es fagocitado
y procesado por los macrófagos. El antígeno así procesado se
incorpora a la membrana celular del macrófago ligado a proteínas del sistema
HLA (sistema de histocompatibilidad), quien lo presenta al linfocito T. Estos
macrófagos, llamados células presentadoras de antígenos activan a un subgrupo
de células T vírgenes denominados CD4+ o linfocitos helper. Los CD4+ activados
comienzan a liberar citoquinas y activan a linfocitos CD8+ citotóxicos que
producen la lisis de las células afectadas, la bacteria intrusa, etc. Pasada la
respuesta celular, algunos linfocitos que reconocen el antígeno nuevo que ha
penetrado en el organismo quedan como centinelas ante posibles reentradas y se
denominan linfocitos-T memoria
Con el envejecimiento, la capacidad proliferativa de los
linfocitos va disminuyendo. Se ha visto que los linfocitos T derivados de
neonatos tienen una capacidad mitótica de 52 divisiones, los de adultos-jóvenes
(20-30 años) alcanzan las 40 divisiones y aquellos de ancianos (70-90 años)
sólo llegan a 32 divisiones (McCarron et al., 1987).
La proliferación conduce al progresivo acortamiento de los
telómeros (porciones más distales de los cromosomas) hasta un punto crítico de
longitud mínima que conduce a la apoptosis. La medición de la longitud de los
telómeros ha mostrado que los de las células CD4+ de los jóvenes tenían una
longitud de 10-12 kb. Se considera que por debajo de 5 kb se ocasiona el
suicidio celular (apoptosis). En este sentido tiene gran importancia el
observar que los telómeros analizados de personas centenarias mostraron una
longitud de 7,5 kb. Esta inusual longitud en los telómeros de los linfocitos de
las personas centenarias ha sugerido que el mantenimiento de una adecuada
actividad inmune es uno de los pilares que condiciona la longevidad como
veremos más adelante.
Respecto de los linfocitos T memoria, sabemos que persisten
durante largo tiempo en nuestro organismo, pero no de manera indefinida. Esta
duración se ha sugerido que es dependiente del antígeno que reconozcan y de las
características y peculiaridades propias de la genética de cada individuo. El
mantenimiento de la memoria inmunológica puede ser problemática en personas muy
mayores, pero también en los jóvenes sometidos a estrés inmunológico crónico
(tumores, infestación por parásitos, infecciones virales persistentes, etc.).
5.4.3.2 Inmunosenescencia humoral
La inmunidad humoral se caracteriza por la participación de
los linfocitos B que actúan frente a los antígenos con respuestas de producción
de moléculas específicas denominadas anticuerpos (inmunoglobulinas). Pasada la
respuesta de inmunidad humoral, quedan algunos linfocitos B memoria y células
plasmáticas que se pueden reactivar ante la nueva entrada del antígeno que las
programó. Se ha visto que con el envejecimiento se reduce la afinidad de los
anticuerpos frente a los antígenos específicos. Además en las respuestas
inmunes humorales que se producen en edades tardías se ha visto que se
incrementa la cantidad de autoanticuerpos.
Con el envejecimiento se va perdiendo la capacidad del
organismo para renovar la población de linfocitos “vírgenes”, de tal manera que
ante un antígeno nuevo existen pocas posibilidades de encontrar una célula
capaz de interaccionar con él y desencadenar la respuesta de inmunidad. Del
mismo modo también van disminuyendo las diversas poblaciones de linfocitos T y
B memoria pues no son renovadas, fruto del envejecimiento celular. La capacidad
de síntesis de anticuerpos está disminuida y lo mismo la de formación de nuevas
inmunoglobulinas.
La inmunosenescencia explica:
§
La reacción de hipersensibilidad retardada que ocurre en la piel
de la personas mayores (Dworsky, et al., 1983).
§
Que las personas mayores sean más sensibles a infecciones banales
que las jóvenes (gripe, etc.).
§
Que las vacunaciones en las personas mayores tengan menos éxito al
no producir la inoculación de los antígenos la respuesta antigénica apropiada
(vacuna antigripal, etc.).
§
El incremento del número y malignidad de las neoplasias al
permitir el sistema inmune por su envejecimiento la presencia y proliferación
de células mutadas.
§
Un decremento de las enfermedades autoinmunes.
§
Por otra parte, una ventaja de la inmunosenescencia es el hecho de
que los transplantes de tejidos u órganos son tolerados más fácilmente que
en los jóvenes y son necesarias dosis más bajas de fármacos inmunosupresores
para impedir el rechazo frente al nuevo injerto.
Un aspecto muy interesante respecto a la relación entre
envejecimiento y respuesta inmune es el hecho observado en personas centenarias
de que los parámetros citológicos y bioquímicos que marcan el estado del
sistema inmune están en valores próximos
a los encontrados en adultos de 40 años (Franceschi, et
al., 1995). Este hecho explicaría de algún modo que el
correcto funcionamiento del sistema inmune juega un papel fundamental en la
longevidad, dadas las importantes acciones de este sistema en el mantenimiento
de nuestra integridad.
@RdzgCarlos Licencia Creative Commons Internacional 4.0



A little note to let everybody know about the powerful work of doctor chimnedum herbal home. My name is Gazalee from Malaysia and i was ones a HEPATITIS and HBP victim until i read about Dr chimnedum herbal home online on how he cured so many people with herbal remedies,and i contacted him for help and he really helped, after i applied his herbal remedies. i am testifying to this great Dr chimnedum herbal home because i want everybody to be informed so that you will contact him today for your cure, Contact him through: dr.chimnedumherbalhome1616@gmail.com Call/Whatsapp: +2347086675538,I'm healed,
ResponderEliminaris a great thing in my life today.